Kimyasal Bağ Kavramının Tarihsel Gelişimi ders notları, konu anlatımı pdf, konu özeti, konu anlatımı pdf, konuları, test pdf, çalışma kağıdı, ders kitabı cevapları, çalışma kitabı cevapları ve yazılı soruları.
Kimyasal Bağ Kavramının Tarihsel Gelişimi
Kimyasal Bağ Kavramının Tarihsel Gelişimi Ders Notu Konu Özeti İndir
Kimyasal Bağ Kavramının Tarihsel Gelişimi :
- Empedokles‘e göre; tabiatta bulunan 4 elementi (toprak, hava, ateş, su) bir arada tutan güç “aşk” ve birbirinden ayıran güç ise “nefret” tir.Tabiatta madde ve kuvvet iki ayrı ilkedir.
- Empedokles’in açıklamaları yaklaşık 2000 yıl geçerliliğini korumuştur.
- Atom fikrini ilk ortaya atan kişiler Leucippus ve Democritus’tur.
- Daha sonra bu düşünürlerin fikirlerini Epicurus desteklemiştir.
- Bu üç Yunanlı düşünüre göre maddelerin sertlik esneklik sertlik tat şekil gibi özelliklerini belirleyen atomlardır. Örneğin tuz; atomları tuzlu olduğu için tuzludur.
- Demokritus’a göre her bir atomun şekil ve büyüklüğü diğerlerinden farklıdır.
- Bazı atomlarda çengeller ve yuvalar bazılarında ise toplar ve oyuklar vardır. Atomlar bir araya geldiğinde çengellerin birbirine takılması ya da topların oyuklara girmesiyle atomlar bir arada tutulur.
- Bugün için saçma görünmesine rağmen o zaman için atomların bağlanma fikrini ortaya atması açısından Democritus’un fikirleri çok önemlidir.
- 17. Yüzyılın ortalarında Fransız bilim adamı Descartes bu görüşleri yeniden gündeme getirdi ve su molekülünün oluşumunu açıklamak için kullandı.
- Dalton atom teorisine göre Democritus ve Descartes’ ın fikirleri kabul edilemez. Çünkü Dalton atomları bölünemez ve içi dolu küreler olarak tanımladı.
- Ancak küre şeklindeki taneciklerin bir arada tutunması ve değişik şekiller verilebilmesi mümkün görünmüyordu.
- Bu nedenle Dalton Atom Teorisi ile atomların bağlanma olgusu açıklanamadı ve bu durum Dalton Atom Teorisinin en büyük eksiği olarak kabul edildi.
- Benjamin Franklin‘in yıldırım ile yaptığı deneyler ve statik elektrik ile ilgili yaptığı deneyler sonucunda maddelerde yüklü taneciklerin bulunması gerektiği fikri ortaya çıktı.
- Stone atomun yapısında olduğuna inanılan eksi(–) yüklü tanecikleri “elektron” olarak tanımladı.
- Bununla birlikte atomların daha küçük taneciklerden oluşmuş olması hipotezi çok yaygınlaşmıştır.
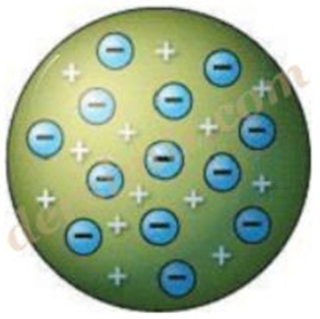
Thomson Atom Modeli : Thomson “Atomlar atom altı taneciklerden oluşur” hipotezi doğrultusunda kendi teorisini geliştirmiş, atomlar “artı(+) ve eksi(–) yüklü tanecikler içerir ve bu yükler atomun içerisinde eşit olarak dağılmışlardır.” demiştir. dersimiz.com
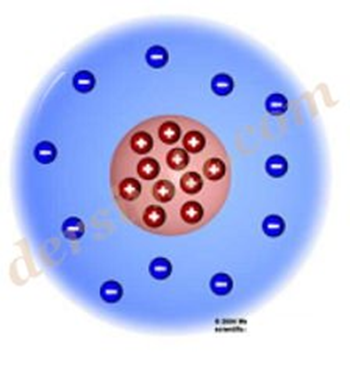
Rutherford Atom Modeli : Thomson’un öğrencisi olan Rutherford kendi atom teorisini ortaya attı ve “Atomda proton adı verilen artı(+) tanecikler çekirdek denilen kısımda toplanmışlardır. Elektron adı verilen eksi(–) yüklü tanecikler ise çekirdeğin etrafında dağılmışlardır.” dedi.
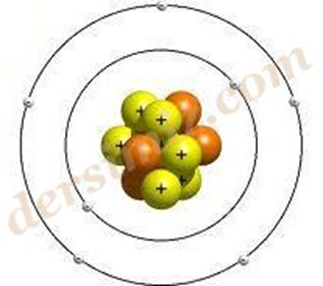
Bohr Atom Modeli : Rutherford atom modelindeki eksiklikleri Bohr kendi atom modeli ile kapatmaya çalıştı. Bohr’a göre “Atomun çekirdeğinde artı(+) yüklü protonlar bulunur. Elektronlar ise çekirdekten belli uzaklıklardaki katmanlarda sürekli hareket halindedir. Isı ve ışığın etkisiyle bu elektronlar çekirdekten uzaklaşabilir. Elektron tekrar eski katmanına dışarıya ışık yayar.”
- Bu atom teorisiyle birlikte atomların birbirine bağlanabilirliği açıklanabilir oldu.
- Bugün biliyoruz ki kimyasal bağ; atomların elektron alış verişleri veya ortaklaşa kullanmalarıyla oluşmuştur.
İşinize Yarayabilir
Kimya Ders Notları, Çalışma Notları, Konu Özetleri Ana Sayfa
Ders Kitabı Cevapları
Tüm Dersler Test Pdf İndir ve Online Test Çöz
Yazılı Soruları Tüm Sınıflar
